人用啤酒酵母和兽用有区别吗?动物使用啤酒酵母粉的作用
人用啤酒酵母和兽用有区别吗?为什么要用这两种东西?我们一起来看看吧。首先,我们要知道什么是啤酒酵母。啤酒酵母是一种真菌,它的形状像一个小蘑菇,有很多细胞胞和分泌物。这些分泌物可以帮助酿造啤酒。它们是麦芽的主要成分,也是啤酒的主要原料。然而,啤酒酵母的生长速度非常快,因此它们不能能被用于酿造啤酒。因此,我们必须从其他地方获得酵母。在中国,有一种特殊的食物,它可以用来酿造啤酒。这种食物就是大麦。
疫苗是一种预防和控制传染病的发生及流行的生物制品,接种疫苗能够诱导产生特异的体液和(或)细胞免疫,从而使机体获得预防该病的免疫力[1, 2]。人类对免疫和疫苗的经验性认知直接来自早期的医学实践,最早可追溯至中国东晋医学家葛洪所著《肘后备急方》中《治卒为犬所咬毒方》所述“乃杀所咬犬,取脑敷之,后不复发”,以及宋真宗时代(998—1002)王素发明的种痘预防天花等,虽然方法并非安全,但上千年来,在人类抗击传染病的斗争中,疫苗的产生及广泛的接种是最有效、最经济、拯救生命数量最多的卫生措施之一[3]。
一、全球人用疫苗发展概况
目前,全球已经批准生产58种人用疫苗,可以预防36种人类传染病。全球人用疫苗发展概况见表1。
二、人用疫苗的研发流程
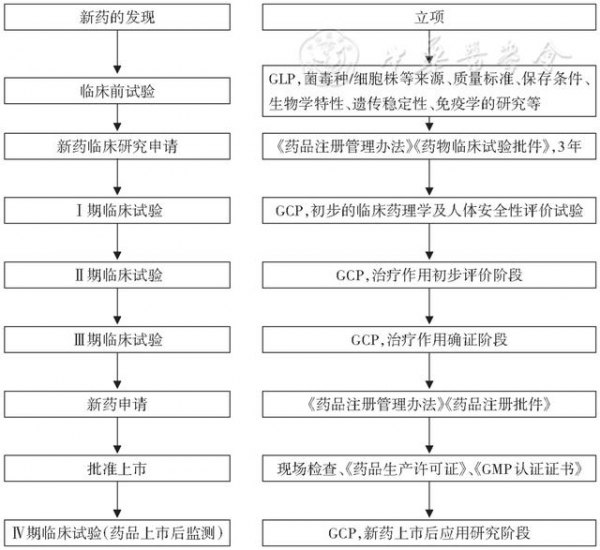
人用疫苗的研发完全按照新药研发的流程进行,包括临床研究、工艺开发和检定方法研究[5]。临床研究是按照一定程序在人体中进行的疫苗安全性和免疫原性研究,包括临床Ⅰ、Ⅱ、Ⅲ、Ⅳ期试验4个阶段。前3期为疫苗上市前的临床试验,Ⅳ期为疫苗上市后的临床试验。检定方法研究涉及建立全套能够检测原料纯度、疫苗产品稳定性和效力以及通过免疫学和其他标准预测疫苗效力的方法[6]。人用疫苗研发流程见图1。
在人用疫苗研发中,工艺开发是关键环节。工艺开发涉及制造符合临床试验监管要求的试验用疫苗,包括多批用于临床试验、临床前毒理学研究和分析评估的疫苗。工艺开发还包括确定最终放大的生产工艺,并通常按1/10或全量的生产规模连续生产3批疫苗供临床免疫原性研究用。人用疫苗工艺可划分为2类:批生产和后处理。批生产包括细胞培养和(或)发酵以及后续的各种疫苗纯化步骤。后处理包括佐剂/防腐剂的加入、西林瓶或者注射器灌装(包括活病毒疫苗冻干)、贴签、包装和入库保藏等[7]。人用疫苗开发的工艺路线见图2。
三、人用疫苗的分类及特点
依据是否含有活微生物体,将疫苗分成两大类,即含活微生物体的疫苗(减毒活疫苗、载体疫苗)和不含活微生物体的疫苗(灭活疫苗、组分疫苗和类毒素疫苗)。灭活疫苗包括全微生物体灭活疫苗、裂解疫苗和亚单位疫苗;组分疫苗包括多核酸疫苗(包括mRNA疫苗和DNA疫苗)、多肽疫苗、基因工程亚单位疫苗、多糖蛋白结合疫苗。
(一)减毒活疫苗
减毒活疫苗是将病原体(细菌、病毒等)经过处理后,使其毒性减弱,接种到机体内,可引发免疫反应,但却不会引发疾病的一种疫苗[8]。生产减毒活疫苗时,选用减毒适宜、毒力低而免疫原性和遗传稳定性均良好的菌、毒种,在敏感培养基(细菌)或适宜动物、鸡胚和细胞培养(病毒)中适应传代以获得较高产量的细菌或病毒,细菌、病毒收获后经过纯化即可。接种减毒疫苗后,病原体在机体内有一定程度的生长繁殖能力,刺激机体产生免疫反应,获得的免疫力较持久,因此接种次数少,受种者反应轻微,但可能出现毒力返祖现象。减毒活疫苗还可能诱导免疫缺陷个体的严重反应[8]。另外,活疫苗的稳定性较差,保存运输较困难,但在制成冻干疫苗后,可增加疫苗稳定性。麻疹疫苗、脊髓灰质炎疫苗以及水痘疫苗等都有减毒活疫苗研制。
口服脊髓灰质炎疫苗(oral polio vaccine,OPV)由Sabin等研制,1963年获得上市许可,其使用的减毒株包括Sabin Ⅰ、Ⅱ、Ⅲ型[8]。OPV通过口服接种,与灭活脊髓灰质炎疫苗(inactivated polio vaccine,IPV)相比,OPV在人体内作用时间长,所需接种的次数少,类似于自然感染,可刺激机体产生免疫反应(体液免疫和肠道局部黏膜免疫)。OPV在很多国家推广使用,可以通过接触者及社区传播获得群体免疫,适合大规模接种,接种方便、便于管理、成本低廉[8]。
我国在消灭脊髓灰质炎的过程中,主要靠中国医学科学院医学生物学研究所以非洲绿猴肾细胞(africa green monkey cell,Vero)生产的三价糖丸及液体疫苗[8]。制备OPV时,首先制备Vero细胞,经过检定后接种病毒,在特定的培养条件下观察细胞病变(cytopathic effect,CPE),收获病毒、去除细胞碎片,病毒滴定和无菌检定,原液合并浓缩后加入稳定剂制成半成品,最后加工成OPV成品[9],具体流程见图3。
(二)载体疫苗
载体疫苗是将病原体的保护性抗原基因插入质粒DNA或细菌的基因组,然后使之高效表达而制备的疫苗。载体疫苗在免疫效力上有优势。载体疫苗用量少,无需纯化抗原,接种后刺激机体产生特异性免疫应答,载体可发挥佐剂效应增强免疫效果;比其他制剂具有更强的稳定性和更长的储存期;易于接种,适合于大规模的免疫,免疫途径简单;易大批量生产,成本低[11]。载体通常为特定微生物的疫苗株,如痘苗病毒、腺病毒、卡介苗等。载体疫苗的缺点是机体内针对载体的抗体(免疫前存在的或免疫后产生的)会对相应载体疫苗的再次免疫效果产生一定影响。
用于制备载体疫苗的载体包括重组细菌载体、重组病毒载体、DNA载体、RNA载体、树突状细胞(dendritic cell,DC)载体、T细胞载体以及多肽载体等(表2)。脂质体(可降解的生物多聚物)、病毒样颗粒(virus-like particles,VLP)和免疫刺激复合物亦可用于疫苗传递系统。其中活的减毒细菌载体,由于能在接种者体内短期存活以及被运载的表达系统可以继续复制等,可以起到抗原放大效应[12]。开发载体疫苗的基本原理在于其可以刺激MHC-Ⅰ类分子产生细胞毒性T淋巴细胞(cytotoxic T lymphocyte,CTL)反应,同时可以诱导产生针对编码抗原的抗体,不同的载体也可以刺激不同的辅助T细胞成熟[13, 14]。在选择疫苗载体时,需要考虑载体是否容易操作、载体容纳外源基因的大小、异源蛋白的表达效率、载体的安全性和载体规模化生产的难易。
解放军军事医学科学院将2014年扎伊尔型(Zaire type)埃博拉病毒(Ebola virus,EBoV)糖蛋白(glycoprotein,GP)重组进腺病毒5型(Adenovirus 5,AdV-5)复制缺陷型病毒载体中制备埃博拉病毒病载体疫苗。2017年10月19日,国家食药监局批准“重组埃博拉病毒病疫苗(腺病毒载体)”的新药注册申请。该疫苗安全有效,可同时激发人体细胞免疫和体液免疫[15],生产工艺见图4。
(三)灭活疫苗
灭活疫苗指先培养细菌或病毒,再用化学剂或高温将其灭活而制备的疫苗[17]。狭义的灭活疫苗由整个细菌或病毒组成,广义的灭活疫苗也包括由其裂解片段组成的裂解疫苗,以及将裂解片段进一步纯化得到的亚单位疫苗。
1.全微生物体灭活疫苗:全微生物体灭活疫苗的生产通常选择遗传稳定性和免疫原性良好、抗原性较全的细菌或病毒种,一般毒力较强。需比较研究不同
全微生物体灭活疫苗生产工艺成熟,稳定性高,不具备感染性,在体内无法增殖,较安全;但受种者接种反应较大,免疫力持久力差,一般需要接种2~3次。随着纯化技术在疫苗生产过程中的应用,灭活疫苗随之改进为纯化的灭活疫苗。制备此类疫苗过程中,收获液含各类有机物、无机物、细胞和细胞碎片,需采用各种分离技术去除杂质,对病毒疫苗中含有的宿主细胞蛋白残留量有明确的限度要求。目前使用的灭活疫苗均为纯化疫苗,如狂犬病疫苗、乙型脑炎疫苗和伤寒疫苗等。
国产人二倍体细胞狂犬病疫苗(human diploid cell rabies vaccine,HDCV),利用生物反应器微载体培养人二倍体细胞(human diploid cell,HDC)MRC-5,在MRC-5细胞上接种PM毒株;收获病毒液;超滤浓缩,利用分子筛柱层析纯化疫苗原液;β-丙内酯灭活病毒;配制形成半成品;再分装冻干制成疫苗成品。生物反应器微载体培养技术提高了HDC培养规模,降低了HDCV批次间的差异,保证了疫苗质量的稳定性和均一性。通过分子筛柱层析进行纯化,可有效去除杂质。此外,国产HDCV对冻干过程中稳定剂和保护剂的组分和冻干工艺进行了优化。国产HDCV热稳定性和效价稳定性良好,质量控制和产品关键指标已处于较高水平,提高了疫苗的免疫效果和安全性,另外短期免疫效果和8年免疫持久性研究结果显示免疫效果良好[19]。从医疗费用方面来看,国产HDCV价格远低于国外HDCV。具体工艺见图5。
2.裂解疫苗:裂解疫苗为多糖疫苗或蛋白疫苗,是对微生物进一步纯化,直至只剩所需抗原成分而产生的。很多侵袭性细菌的表面覆盖一层荚膜,主要成分是多糖。多糖疫苗目标易确定,但免疫原性弱,诱导的保护期限有限,对婴幼儿的免疫原性有限[20]。在脑膜炎球菌疫苗研发历程中,早期开发的是全菌体灭活疫苗,由于接种反应大而终止应用;之后研发脑膜炎球菌多糖疫苗,通过培养A群脑膜炎球菌,收取培养物,杀菌,去菌体,纯化制成多糖疫苗,接种多糖疫苗后副作用罕见,对预防控制大龄儿童和成人的相关疾病效果显著,但临床研究发现,年龄<2岁婴幼儿的免疫应答低下甚至缺乏,表明其免疫原性与受种者年龄相关[20]。目前广泛使用的多糖疫苗有23价肺炎球菌多糖疫苗、伤寒Vi多糖疫苗等[20]。
23价肺炎球菌多糖疫苗利用我国地方医院分离出的23个最常见的致病性肺炎链球菌菌株,经过培养提取荚膜多糖、纯化后混合制备而成。该产品通盖了国内90%的致病性肺炎球菌,符合美国23价肺炎球菌多糖疫苗的血清型(1、2、3、4、5、6B、7F、8、9N、9Ⅴ、10A、11A、12F、14、15B、17F、18C、19F、19A、20、22F、23F和33F),质量标准符合《欧洲药典》,免疫原性和安全性达到国际水平。23价肺炎球菌多糖疫苗的接种对象为所有>2岁人群,接种反应轻微,对高危人群保护效果良好,临床研究显示,接种后3周左右可产生保护,保护期一般≥5年[21, 22],生产工艺见图6。
3.亚单位疫苗:亚单位疫苗是从病原体分离提取具有免疫原性的蛋白组分制成,成分更加单一[24]。疫苗接种是目前预防流感的唯一有效措施,目前广泛使用的季节性流感疫苗包括全病毒灭活疫苗、裂解疫苗以及亚单位疫苗。其中全病毒灭活疫苗接种后不良反应发生率较高,使用逐渐减少;流感病毒亚单位疫苗则由于更好的安全性,应用逐渐增多。亚单位疫苗质量控制标准严格,产品纯度高,临床免疫效果显著,可以提高流感疫苗的安全性,消除了佐剂带来的不良反应,消除了硫柳汞引起的毒副作用,不良反应发生率低。流感全病毒灭活疫苗的接种对象为>12岁人群,而流感病毒亚单位疫苗则可用于包括>6个月人群。
生产3价流感病毒亚单位疫苗时,采用WHO推荐的流感甲1(H1N1)、甲3(H3N2)和乙型疫苗株(北半球)分别接种鸡胚/细胞培养,收获病毒液经灭活、浓缩、裂解和纯化等工艺处理后制成。来自鸡胚培养的流感病毒亚单位疫苗的制备包括:病毒接种,病毒增殖培养,尿囊液收获,澄清,超滤浓缩,灭活,裂解和超速离心纯化,凝胶过滤层析纯化(超滤),混配,过滤除菌,分装,包装等[25, 26],生产工艺见图7。
(四)组分疫苗
组分疫苗是指将致病病原体主要的保护性免疫原组分制成的疫苗,包括核酸疫苗、多肽疫苗、基因工程亚单位疫苗等。
1.多肽疫苗:多肽疫苗即根据病毒的氨基酸序列合成的一段多肽生产的疫苗,是用化学合成法合成类似于抗原决定簇的小肽(约20~40个氨基酸),最早的研究为口蹄疫病毒(foot and mouth disease virus,FMDV)的单独B细胞抗原表位或与T细胞抗原表位结合而制备的合成肽疫苗研究[28]。全球仅有一款多肽疫苗已上市,即2011年获批上市的古巴的Cimavax-EGF疫苗,用于ⅢB期、Ⅳ期非小细胞肺癌的治疗性疫苗,Ⅲ期临床显示能将受试者5年生存期提高近1倍至14.4%(对照组为7.9%)[29]。
多肽疫苗生产的核心步骤为多肽的合成、纯化,根据设计可能有其他工艺。多肽疫苗具有价廉、安全、特异性强、容易保存和应用的优点,但是免疫原性差、功效低以及半衰期短等不足影响其实际应用。可被CTL识别的肽表位对预防感染和慢性病的免疫治疗是一种非常有用的免疫原[30]。在设计中应注意:(1)是否激发CTL和辅助淋巴细胞;(2)选择性结合MHC-I/MHC-Ⅱ类分子,刺激辅助性T细胞的功能;(3)与适合的佐剂配伍,促进与DC传递信号,活化抗原提呈细胞(antigen presenting cell,APC),促进T细胞应答反应;(4)通过对肽的修饰、空间结构的调整以及联合DC等措施,增强肽分子与MHC分子的结合;(5)通过化学修饰,增强肽分子的稳定性。
从一个多肽中利用保护性抗体鉴别B细胞表位的设计技术已被证明是可行的,虽然某些保护性表位在整条多肽链中仅具有很弱的免疫原性,但经修饰和合理折叠后则可具有良好的免疫原性[25]。有许多设计策略可以增强B细胞表位的免疫原性:(1)融合蛋白,利用基因工程技术将表位与载体蛋白进行融合,形成大的蛋白质颗粒,从而增强免疫呈递能力,融合可以发生在N末端、C末端或伴侣蛋白的内部,以获得最为有效的免疫原性为基础;(2)连接体,利用化学方法将表位肽与载体蛋白(如破伤风类毒素)进行连接;(3)复合肽,采用人工合成方式合成彼此连接的肽段重复阵列。
2.基因工程亚单位疫苗:基因工程亚单位疫苗是利用重组DNA技术克隆并表达保护性抗原基因,它可以是重组体本身或者表达的抗原产物。表达外源抗原的表达系统主要有细菌、酵母、哺乳动物细胞和昆虫细胞等。见表3。基因工程亚单位疫苗产量高、稳定性好,具有良好的安全性,为增加免疫原性通常使用佐剂。

预防人乳头瘤病毒(human papillomavirus,HPV)感染最有效的手段是接种HPV疫苗。HPV具有严格的种属特异性和组织特异性,需要宿主细胞处于特定的分化状态,难以在其他动物中繁殖或进行体外培养,因此HPV疫苗无法采用传统方法生产,现在已上市的以及研制中的HPV疫苗大多属于基因工程VLP疫苗。将HPV L1蛋白体外重组表达,经过纯化并组装成VLP,吸附佐剂并最后配制成多价疫苗。HPV VLP在结构和表位上与天然HPV衣壳高度相似,具有良好的免疫原性,但不含有任何基因组成分,不能复制,安全性高。
HPV疫苗制备过程中大多有重装步骤,以实现VLP的均一性,GSK公司在研发HPV疫苗时,首次采用了昆虫细胞-杆状病毒表达系统制备L1蛋白。首先需要构建能够表达各型L1蛋白的杆状病毒株:利用PCR从不同型HPV阳性病理组织获取各型L1核酸序列;将获得的L1核酸序列通过克隆技术构建各型L1蛋白转移载体,再进一步构建穿梭质粒;将穿梭质粒转染拟尺蠖细胞(以下简称Hi5细胞),获得能够表达L1蛋白的杆状病毒株[31];该病毒株可通过再感染细胞进行扩增。生产工艺见图8。
Merck公司的Gardasil研制采用的是酿酒酵母表达系统,首先将HPV基因经密码子优化,成为在酵母中能高效表达的密码子,然后进行超滤、离子交换层析、羟基磷灰石层析等步骤,再在体外解聚,组装形成均匀一致的VLP,随后,吸附铝佐剂制成疫苗[32]。
另外,在生产重组和亚单位等疫苗时,需要借助细胞系或微生物作为表达系统,采用不同的表达系统也会对疫苗生产造成影响,因为不同的表达系统在糖基化、产量、费用等方面不同。
3.多糖蛋白结合疫苗:多糖疫苗对人体免疫原性较差,特别是儿童。多糖分子小,研究证明只有高分子量的多糖抗原才能诱导人体产生足够的抗体应答。为增加多糖的免疫效应,20世纪80年代开始结合疫苗的研究。
以蛋白为载体的细菌多糖类结合疫苗是指采用化学方法将多糖共价结合在蛋白载体上生产的多糖-蛋白结合疫苗,可以提高细菌疫苗多糖抗原的免疫原性。结合疫苗中的蛋白质具有胸腺依赖性抗原特征,可将非T细胞依赖性性质的多糖抗原转变为T细胞依赖性抗原,启动T辅助淋巴细胞,从而产生一系列的免疫增强效应。结合疫苗除可增加婴幼儿对细菌多糖的免疫效应外,有些结合疫苗可为二联疫苗,接种人体后可获得对2种疾病的免疫力。2012年5月,2种ACYW135群脑膜炎球菌多糖-蛋白结合疫苗在美国注册并被推荐为青少年和年轻成年人常规免疫接种疫苗。
美国辉瑞公司于2010年初研发的13价肺炎球菌结合疫苗(包含血清型1、3、4、5、6A、6B、7F、9Ⅴ、14、18C、19A、19F和23F型)通过美国FDA批准上市。该疫苗增加了近期发病率较高的6种血清型肺炎球菌多糖,使其在美国和发展中国家的血清型覆盖率分别达到90%和80%以上。该疫苗中每个血清型细菌培养收获后,通过离心分离、沉淀、超滤和柱层析法来提纯多糖。将肺炎多糖通过还原氨法与CRM197蛋白直接共价结合形成单型肺炎多糖结合疫苗。CRM197蛋白是一种白喉无毒突变株表达的蛋白。对结合物的质量控制主要包括分析多糖/蛋白比例、分子大小、游离糖及游离蛋白等项目。将13种结合物原液混合,并用磷酸铝佐剂吸附后分装制成白色均匀混悬液。其生产工艺见图9。13价肺炎球菌结合疫苗覆盖了13种最常见肺炎球菌血清型,采用结合疫苗技术,促成免疫记忆,当细菌入侵时,能及时产生抗体;提供长效保护,提供更强的保护力[33]。
(五)核酸疫苗
核酸疫苗分为DNA疫苗和RNA疫苗,是利用现代生物技术,将编码某种抗原蛋白的外源基因(RNA或DNA)直接导入动物体细胞内,通过宿主细胞的表达系统合成抗原蛋白,诱导宿主产生对该抗原蛋白的免疫应答,从而预防和治疗疾病[34]。
DNA疫苗导入宿主体内后,在细胞内表达病原体的蛋白质抗原,刺激机体产生免疫反应。DNA疫苗易于制备,便于保存,可多次免疫,能诱发全面免疫应答。至今已有艾滋病、流感、单纯疱疹、乙型肝炎、疟疾等多种DNA疫苗进行了临床研究,已有兽用DNA疫苗上市。提高DNA疫苗的抗原表达,提高免疫原性和抗感染的免疫保护力,仍是DNA疫苗研究领域中的关键问题。另外,DNA进入体内,存在与人基因组重组的风险,安全性有待验证[35]。
相对于DNA疫苗,mRNA疫苗是一种比较安全的新型核酸疫苗。mRNA疫苗的分子设计及化学修饰的研究目前主要集中于增强其稳定性和免疫原性。mRNA疫苗的传递介质主要包括脂质体、非脂质体、病毒、纳米颗粒等[36]。mRNA疫苗用于肿瘤、感染性疾病等的防治研究表明其具有良好的效果,有较好的应用前景。主要具有以下优点:(1)可以表达任意种类的蛋白,由蛋白疫苗转为mRNA疫苗绕过现有大部分专利,大规模化学合成mRNA技术已经成熟;(2)研发速度远超传统蛋白疫苗,美国Moderna公司的新型冠状病毒mRNA疫苗从开始研发到进入临床,仅用63 d;(3)成本低,序列设计及优化均通过生物信息学完成;(4)非特异免疫性较低,可以反复多次使用;(5)和灭活或减毒疫苗相比,本身无感染性,安全性较高;(6)可编码完整抗原,比多肽疫苗更有效;(7)可模拟天然病毒感染途径,发生系统药效(激活CD8+细胞);(8)生产为标准化操作,容易放大生产,周期短,成本低,可应对大规模突发性传染病;(9)DNA疫苗相比不会引起整合性突变,更为安全;(10)无需进入细胞核,而DNA疫苗需专门递送设备进入细胞;(11)从老鼠到人的转化已得到证实,DNA疫苗在高等动物上效果仍有待确认;(12)通过正常细胞内途径降解,半衰期可以通过化学修饰和导入方法调节;(13)易于制备多价联苗,而无需担心稳定性;(14)mRNA自身有很强的佐剂效应,通过激活TLRs(Toll-like receptors)使免疫效果增强;(15)安全性在临床上已得到证实(Ⅰ期结果)。然而,mRNA疫苗目前还没有上市产品,在有效性和安全性方面仍存在争议,审批难度较大。
(六)类毒素疫苗
类毒素疫苗是用丧失毒性而保留免疫原性的毒素所制成的疫苗。破伤风类毒素(tetanus toxoid,TT)是典型的类毒素疫苗。破伤风梭状芽孢杆菌是破伤风的致病因子,在环境中分布广泛。当破伤风梭状芽孢杆菌的芽孢进入厌氧环境中,就会成为能产毒素的菌体。破伤风的临床表现是这种毒素对中枢神经系统的作用所致。1924年,应用化学灭活方法获得TT研制成功,可在暴露前诱导抗破伤风的主动免疫,现在仍在广泛应用。在适宜产毒的培养基中培养破伤风梭状芽孢杆菌,过滤除菌后收获毒素,甲醛脱毒制成TT,纯化后灭菌,最后以铝盐或钙盐吸附。见图10。TT稳定,在37 ℃下贮存数周疫苗效力不会出现明显下降,但56 ℃ 2 h可破坏TT。TT冷冻后不应再使用。
四、展望
疫苗对实现健康战略目标具有十分重要的意义。虽然疫苗在公共卫生领域中取得了很大的成功,但仍面对着许多问题和挑战。仅在2017年,全球就至少有150万名儿童死于疫苗可预防的疾病,而且许多威胁人类健康的传染病至今仍然没有成功研制出可用的疫苗。据统计,对人类致病的微生物共有1 415种,其中有217种病毒和朊病毒、538种细菌和立克次体、307种真菌、66种原生动物、287种寄生虫。目前仍然有多种病原体还没有相应的疫苗,包括:病毒类(EB病毒、巨细胞病毒、丙型肝炎病毒、HIV、疱疹病毒、呼吸道合胞病毒、鼻病毒、登革病毒)、细菌类[弯曲杆菌、A群和B群链球菌、幽门螺旋杆菌、结核杆菌(疫苗效果不好)、志贺杆菌、耐药性金护航色葡萄球菌]、衣原体、寄生虫(疟原虫、利士曼原虫、血吸虫)。对于流感,现有疫苗保护率有限,还没有通用流感疫苗。诸如尿路感染、过敏性疾病、自身免疫性疾病、癌症等疾病还没有疫苗可以应用。
随着结构生物学、生物信息学、计算生物学、系统生物学、现代免疫学和纳米技术、剂型技术等新知识和新技术的发展,使抗原表位作图、抗原设计、新型佐剂和免疫检测的研究进入新的时代[37]。在重大、突发传染病面前,人类不再毫无反抗之力,新型冠状病毒疫苗从开始研发到进入临床仅耗时63 d,这离不开科技发展带来的新技术的应用。
参考文献
1. Understanding modern-day vaccines: what you need to know[J]. Ann Med, 2018, 50(2):110-120. .
2.WickerS, MaltezouHC. Vaccine-preventable diseases in Europe: where do we stand?[J]. Expert Rev Vaccines, 2014, 13(8):979-987. .
3.AdamsA. Progress, challenges and opportunities in fish vaccine development[J]. Fish Shellfish Immunol, 2019, 90:210-214. .
4.赵铠.疫苗研究与应用[M].1版. 北京:人民卫生出版社,2013.
5.GuimarãesLE, BakerB, PerriconeC, et al. Vaccines, adjuvants and autoimmunity[J]. Pharmacol Res, 2015, 100:190-209. .
6.SeyboldU. [Vaccination: What′s new?][J]. Dtsch Med Wochenschr, 2018, 143(15):1086-1089. .
7.RappuoliR, HanonE. Sustainable vaccine development: a vaccine manufacturer′s perspective[J]. Curr Opin Immunol, 2018, 53:111-118. .
8.MinorPD. Live attenuated vaccines: Historical successes and current challenges[J]. Virology, 2015, 479-480∶379-392. .
9.邢力莉, 曹玲生. 脊髓灰质炎疫苗接种现状与进展[J].中国疫苗和免疫, 2018, 24(2):243-248.
10.赵铠,章以浩,李河民.医学生物制品学[M].2版. 北京:人民卫生出版社,2010.
11.RauchS, JasnyE, SchmidtKE, et al. New vaccine technologies to combat outbreak situations [J]. Front Immunol, 2018, 9:1963. .
12.De VleeschauwerAR, ZhouX, LefebvreDJ, et al. A canine adenovirus type 2 vaccine vector confers protection against foot-and-mouth disease in guinea pigs[J]. Vaccine, 2018, 36(16):2193-2198. .
13.张波, 陈冠军, 张兆山. 细菌载体疫苗的研究进展[J].微生物学免疫学进展, 2002, 30(2):86-90. .
14.ApostolopoulosV. Vaccine Delivery Methods into the Future[J]. Vaccines (Basel), 2016, 4(2). .
15.潘卫兵, 刘莹. 埃博拉疫苗研究进展[J].医学信息, 2020, 33(1):36-38, 42. .
16.朱涛. 重组腺病毒载体埃博拉疫苗的工艺特点和技术创新[J].生物技术通讯, 2017, 28(1):12-15. .
17.Del GiudiceG, RappuoliR. Inactivated and adjuvanted influenza vaccines[J]. Curr Top Microbiol Immunol, 2015, 386:151-180. .
18.KarchCP, BurkhardP. Vaccine technologies: From whole organisms to rationally designed protein assemblies[J]. Biochem Pharmacol, 2016, 120:1-14. .
19.ZhouX, WuX, CaiY, et al. Pre-marketing immunogenicity and safety of a lyophilized purified human diploid cell rabies vaccine produced from microcarrier cultures: a randomized clinical trial[J]. Hum Vaccin Immunother, 2019, 15(4):828-833. .
20.NiY, SpringerMJ, GuoJ, et al. Development of a synthetic Vi polysaccharide vaccine for typhoid fever[J]. Vaccine, 2017, 35(51):7121-7126. .
21.BericalAC, HarrisD, Dela CruzCS, et al. Pneumococcal Vaccination Strategies. An Update and Perspective[J]. Ann Am Thorac Soc, 2016, 13(6):933-944. .
22.BreimanRF, KellerDW, PhelanMA, et al. Evaluation of effectiveness of the 23-valent pneumococcal capsular polysaccharide vaccine for HIV-infected patients[J]. Arch Intern Med, 2000, 160(17):2633-2638. .
23.杨晓明,高福,俞永新,等.当代新疫苗[M].2版. 北京:高等教育出版社,2020.
24.BillRM. Recombinant protein subunit vaccine synthesis in microbes: a role for yeast?[J]. J Pharm Pharmacol, 2015, 67(3):319-328. .
25.WeigelT, SolomaierT, WehmeyerS, et al. A membrane-based purification process for cell culture-derived influenza A virus[J]. J Biotechnol, 2016, 220:12-20. .
26.BucklandBC. The development and manufacture of influenza vaccines[J]. Hum Vaccin Immunother, 2015, 11(6):1357-1360. .
27.高辉.一种三价流感病毒亚单位疫苗及其制备方法:中国,10459672.8 [P].2018-01-05.
28.万岩岩, 钟静静, 高宁宁, 等. 肿瘤多肽疫苗的研究进展[J].动物医学进展, 2015, (2):102-106. .
29.SaavedraD, CrombetT. CIMAvax-EGF: A New Therapeutic Vaccine for Advanced Non-Small Cell Lung Cancer Patients[J]. Front Immunol, 2017, 8:269. .
30.朱颐申, 张霓. 多肽疫苗研究进展[J].中国疫苗和免疫, 2013, 19(1):69-74.
31.MyhrAI. DNA Vaccines: Regulatory Considerations and Safety Aspects[J]. Curr Issues Mol Biol, 2017, 22:79-88. .
32.WangJW, RodenRB. Virus-like particles for the prevention of human papillomavirus-associated malignancies[J]. Expert Rev Vaccines, 2013, 12(2):129-141. .
33.GruberWC, ScottDA, EminiEA. Development and clinical evaluation of Prevnar 13, a 13-valent pneumocococcal CRM197 conjugate vaccine[J]. Ann N Y Acad Sci, 2012, 1263:15-26. .
34.PorterKR, RaviprakashK. DNA Vaccine Delivery and Improved Immunogenicity[J]. Curr Issues Mol Biol, 2017, 22:129-138. .
35.MyhrAI. DNA Vaccines: Regulatory Considerations and Safety Aspects[J]. Curr Issues Mol Biol, 2017, 22:79-88. .
36.IavaroneC, O′haganDT, YuD, et al. Mechanism of action of mRNA-based vaccines[J]. Expert Rev Vaccines, 2017, 16(9):871-881. .
37.KoffWC, BurtonDR, JohnsonPR, et al. Accelerating next-generation vaccine development for global disease prevention[J]. Science, 2013, 340(6136):1232910. .
The End